Viktoza - udhëzime zyrtare * për përdorim
Forma e dozimit - zgjidhje për administrim nënlëkuror: pa ngjyrë ose pothuajse e pangjyrë (3 ml secila * në fishekë qelqi, të cilat mbyllen në një stilolaps plastik të disponueshëm për injeksione të përsëritura, në një pako kartoni prej 1, 2 ose 3 stilolapsa shiringash).
* Në 1 stilolaps shiringë (3 ml) përmban 10 doza prej 1.8 mg, 15 doza prej 1.2 mg ose 30 doza prej 0.6 mg.
Substanca aktive: liraglutide, në 1 ml - 6 mg.
Përbërësit ndihmës: acidi klorhidrik / hidroksid natriumi q.s., dihidrat fosfat hidrogjeni natriumi, fenol, glikol propilen, ujë për injeksion.
Karakteristikat farmakologjike:
pharmacodynamics
Liraglutide ka një efekt të gjatë 24-orësh dhe përmirëson kontrollin e glicemisë duke ulur përqendrimin e glukozës në gjak që agjëron dhe pas ngrënies te pacientët me diabet tip 2.
Sekretimi i insulinës në varësi të glukozës
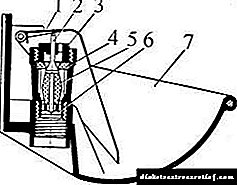
Me një rritje të përqendrimit të glukozës në gjak, liraglutidi rrit sekretimin e insulinës. Kur përdorni infuzion glukozë hap pas hapi, sekretimi i insulinës pas administrimit të një doze të vetme liraglutidi tek pacientët me diabet mellitus tip 2 rritet në një nivel të krahasueshëm me atë të subjekteve të shëndetshëm (Fig. 1).

Funksioni i qelizave beta pankreatike
Liraglutide përmirësoi funksionimin e qelizave beta të pankreasit, siç dëshmohet nga faza e parë dhe e dytë e përgjigjes së insulinës dhe aktiviteti sekret maksimal i qelizave beta. Studimet farmakodinamike të pacientëve me diabet të tipit 2 treguan rivendosjen e fazës së parë të sekretimit të insulinës (administrimi intravenoz i insulinës), përmirësimi i fazës së dytë të sekretimit të insulinës (testi i kapëses hiperglicemike) dhe aktiviteti maksimal sekretar i insulinës (testi i stimulimit të argininës).
Gjatë terapisë 52-javore me Victoza ®, pati një përmirësim në funksionin e qelizave beta të pankreasit, siç dëshmohet nga vlerësimi i modelit homeostatik të funksionit të qelizave beta të pankreasit (indeksi HOMA) dhe raporti i insulinës me proinsulin.
Sekretimi i glukagonit:
Liraglutide, duke stimuluar sekretimin e insulinës dhe duke penguar sekretimin e glukagonit, zvogëlon përqendrimin e glukozës në gjak. Liraglutide nuk pengon përgjigjen e glukagonit në përqendrime të ulëta të glukozës. Përveç kësaj, në sfondin e liraglutidit, u vërejt prodhimi më i ulët i glukozës endogjene.
Boshllëku i stomakut:
Liraglutide shkakton një vonesë të vogël në zbrazjen e stomakut, duke zvogëluar kështu intensitetin e glukozës postprandiale në gjak.
Pesha e trupit, përbërja e trupit dhe shpenzimi i energjisë:
Në subjektet me rritje të peshës trupore të përfshirë në studimet klinike afatgjata të liraglutide, kjo e fundit shkaktoi një rënie të konsiderueshme të peshës trupore. Skanimi duke përdorur tomografinë e llogaritur (CT) dhe metodat e absorbimit të rrezeve me rreze X të energjisë (DERA) treguan se humbja e peshës trupore ndodhi kryesisht për shkak të humbjes së indit dhjamor të pacientëve. Këto rezultate shpjegohen me faktin se gjatë terapisë me liraglutide në pacientë, uria dhe konsumi i energjisë zvogëlohen.
Elektrofiziologjia e zemrës (Efc):
Efekti i liraglutidit në procesin e repolarizimit në zemër u testua në një studim të EFS. Përdorimi i liraglutidit në përqendrimin e ekuilibrit në një dozë ditore deri në 1.8 mg nuk prodhon zgjatje të EPS.
Efikasiteti klinik
3992 pacientë me diabet mellitus tip 2 u rastizuan në 5 prova klinike të dyfishta të sigurisë dhe efikasitetit të kryera për të vlerësuar efektin e Victoza ® në kontrollin e glicemisë. Terapia me Victoza has ka prodhuar një përmirësim klinik dhe statistikisht të rëndësishëm në HbA1cpërqendrimet e glukozës dhe agjërimit postprandial të glukozës në krahasim me placebo.
Kontrolli i glicemisë
Ilaçi Viktoza ® në formën e monoterapisë për 52 javë shkaktoi një statistikisht domethënës (p, ndërsa te pacientët që marrin pjesë në provat klinike të përdorimit të kombinuar të barit Victoza ®, mesatarja e HbA1c ulur me 1.1-2.5%.
Ilaçi Viktoza ® gjatë terapisë së kombinuar 26-javore me metformin, preparate sulfonilure ose metforminë dhe tiazolidinedione shkaktoi statistikisht domethënës (p ® dhe metformin, shtimi i insulinës detemir siguronte efikasitet më të madh në krahasim me ilaçin Victoza ® dhe metformin pas 26 javësh trajtimi (ulje HbA1c me 0,52%).
Shtë vërtetuar se efektiviteti i ilaçit Victoza a në një dozë prej 0.6 mg në kombinim me përgatitjet sulfonilurea ose metformin është superiore ndaj placebo, por në të njëjtën kohë më e ulët sesa në doza 1.2 mg dhe 1.8 mg.
Raporti i pacientëve që kanë arritur një ulje të HbA1c
Përkundër sfondit të monoterapisë me Viktoza ® gjatë një studimi 52-javor, numri i pacientëve që arritën HbA1c Combination në kombinim me metformin, derivatet e sulfonylurea, ose një kombinim të metforminës dhe tiazolidinedione, numri i pacientëve që kanë arritur HbA1c ≤ 6.5%, statistikisht domethënës (p) 0.0001) u rrit në lidhje me numrin e pacientëve që morën terapi vetëm, pa shtimin e Victoza drugs, me ilaçe hipoglikemike.
Në grupet e pacientëve që nuk kanë arritur kontroll të duhur glicemik gjatë terapisë me Victoza ® dhe metformin, përqindja e pacientëve që kanë arritur objektivin HbA1c (® arriti HbA1c ® si në formën e monoterapisë, ashtu edhe në kombinim me një ose dy agjentë hipoglikemikë oralë. Kjo ulje është vërejtur tashmë në dy javët e para nga fillimi i trajtimit.
Glikemia postprandiale
Përdorimi i drogës Victoza ® për tre ditë të marrjes së ushqimit standard ndihmoi në uljen e përqendrimit të glukozës postprandiale me 31-49 mg% (1.68-2.71 mmol / l).
Pesha e trupit
Monoterapia 52-javore me Viktoza ® u shoqërua me humbje të qëndrueshme të peshës.
Gjatë gjithë periudhës së studimit klinik, humbja e qëndrueshme e peshës është shoqëruar edhe me përdorimin e Victoza ® në kombinim me metformin dhe në kombinim me metformin dhe sulfonylureas ose një kombinim të metforminës dhe tiazolidinedione.
Humbja e peshës në pacientët që marrin Victoza ® në kombinim me metformin u vërejt gjithashtu pas shtimit të insulinës detemir.
Ulja më e madhe në peshën e trupit është vërejtur tek pacientët që kishin një indeks të rritur të masës trupore (BMI) në pikën fillestare të studimit.
Monoterapia me Viktoza ® për 52 javë shkaktoi një rënie në vëllimin mesatar të belit me 3.0-3.6 cm.
Një rënie në peshën e trupit është vërejtur në të gjithë pacientët që marrin terapi me Victoza ®, pavarësisht nëse ata kanë përjetuar një reagim negativ në formën e nauze.
Ilaçi Viktoza ® si pjesë e terapisë së kombinuar me metforminën zvogëloi vëllimin e yndyrës nënlëkurore me 13-17%.
Steatohepatosis jo alkoolike
Liraglutide zvogëlon ashpërsinë e steatohepatosis në pacientët me diabet tip 2.
Presioni i gjakut
Studimet klinike afatgjata kanë treguar që ilaçi Victoza ® ul presionin e gjakut sistolik me një mesatare prej 2.3-6.7 mm Hg. në dy javët e para të trajtimit. Një rënie në presionin sistolik të gjakut ka ndodhur para fillimit të humbjes së peshës.
Të dhëna të tjera klinike
Në një studim krahasues të efikasitetit dhe sigurisë së ilaçit Victoza ® (në doza 1.2 mg dhe 1.8 mg) dhe frenuesit e diagliptinës dipeptidil peptidaza-4 në një dozë prej 100 mg në pacientët që nuk arritën kontroll të duhur në terapinë me metformin, ulja më e mirë u vërtetua pas 26 javësh të trajtimit indeksi i HBA1c kur përdorni ilaçin Victoza ® në të dy dozat në krahasim me sitagliptinën (-1.24%, -1.50% krahasuar me -0.90%, p ® në krahasim me sitagliptin (43.7% dhe 56.0% nga krahasuar me 22.0%, p ® ishte dukshëm më e lartë në krahasim me pacientët që morën sitagliptinë (-2.9 kg dhe -3.4 kg, krahasuar me -1.0 kg, p ®, nauze ishte më e zakonshme. Megjithatë nauzeja ishte kalimtare, dhe incidenca e hipoglikemisë së butë nuk ishte dukshëm e ndryshme kur trajtohej me Victoza ® dhe sitagliptin (0.178 dhe 0.161, krahasuar me 0,106 raste / pacient në vit).1c dhe avantazhi i Viktoza ® në krahasim me sitagliptin është vërejtur pas javës së 26 të trajtimit me Viktoza ® (1.2 mg dhe 1.8 mg) dhe është konfirmuar pas javës së 52-të të trajtimit (-1.29% dhe -1.51% krahasuar me -0.88%, p ®, gjë që çoi në një ulje shtesë dhe statistikisht të rëndësishme në HbA1c në javën e 78-të të trajtimit (0.24% dhe 0.45%, 95 Cl: nga 0.41 në 0.07 dhe nga -0.67 në 0.23).
Në një studim krahasues të efikasitetit dhe sigurisë së ilaçit Victoza (me dozë prej 1.8 mg) dhe ekzenatide (në dozë prej 10 μg dy herë në ditë) në pacientët që nuk arritën kontroll të duhur në terapi me metforminë dhe / ose derivate të sulfonylurea, pas 26 javësh të përdorimit të ilaçit Victoza ® vuri në dukje një ulje më të madhe të HbA1c në krahasim me exenatide (-1.12% krahasuar me -0.79%, p ® në krahasim me exenatide (54.2% krahasuar me 43.4%, p = 0.0015). Të dy terapitë treguan një humbje mesatare pesha trupore afërsisht 3 kg. Numri i pacientëve që raportuan nauze ishte më i ulët në grupin e pacientëve që pranonin ilaçin Viktoza ®, krahasuar me exenatide. Incidenca e hipoglikemisë së butë ishte dukshëm më e ulët në grupin e pacientëve që pranonin ilaçin Viktoza ®, krahasuar me exenatide ( 1 932 krahasuar me 2 600 raste / pacient në vit, p = 0.01). Pas 26 javësh të administrimit të ekzenatidit, pacientët do të u transferuan në Victoza ®, gjë që çoi në një rënie shtesë të HbA1c në javën e 40-të të trajtimit (-0.32%, p ® për 52 javë përmirësuar ndjeshmërinë ndaj insulinës në krahasim me atë të përgatitjeve sulfonilurea, e cila u zbulua duke përdorur modelin homeostatik për vlerësimin e rezistencës së insulinës HOMA-IR.
Farmakokinetika
thithje
Thithja e liraglutidit pas administrimit nënlëkuror është e ngadaltë, koha për të arritur përqendrimin maksimal të plazmës është 8-12 orë pas dozës së barit. Përqendrimi maksimal (Cmax) liraglutidi në plazëm pas injektimit nënlëkuror në një dozë të vetme prej 0.6 mg është 9.4 nmol / L. Me futjen e liraglutidit në një dozë prej 1.8 mg, treguesi mesatar i përqendrimit të tij të plazmës ekuilibër (AUC?/24) arrin afërsisht 34 nmol / L. Ekspozimi i liraglutidit përmirësohet në përpjesëtim me dozën e administruar. Pas administrimit të liraglutidit në një dozë të vetme, koeficienti i intrapopulimit të variacionit në zonën nën kurbën e përqendrimit-kohë të AUC është 11%. Disponueshmëria biologjike e liraglutidit pas administrimit nënlëkuror është afërsisht 55%.
shpërndarje
Vëllimi i dukshëm i shpërndarjes së liraglutidit në indet pas administrimit nënlëkuror është 11-17 litra. Vëllimi mesatar i shpërndarjes së liraglutidit pas administrimit intravenoz është 0.07 l / kg. Liraglutidi kryesisht lidhet me proteinat plazmatike (> 98%).
metabolizëm
Për 24 orë pas administrimit për vullnetarë të shëndetshëm të një doze të vetme të 3 H-liraglutide të etiketuar me izotopin radioaktiv, përbërësi kryesor plazmatik mbeti liraglutid i pandryshuar. Janë zbuluar dy metabolitë plazma (≤ 9% dhe ≤ 5% e radioaktivitetit të përgjithshëm plazmatik). Liraglutide metabolizohet në mënyrë endogjene, si proteina të mëdha, pa përfshirë ndonjë organ specifik si rrugë ekskretuese.
mbarështim
Pas një dozë prej 3 H-liraglutide u administrua, liraglutidi i pandryshuar nuk u zbulua në urinë ose feces. Vetëm një pjesë e vogël e radioaktivitetit të administruar në formën e metabolitëve të shoqëruar me liraglutide (përkatësisht 6% dhe 5%) u ekskretua nga veshkat ose përmes zorrëve. Substancat radioaktive ekskretohen nga veshkat ose përmes zorrëve, kryesisht gjatë 6-8 ditëve të para pas dozës së barit, dhe janë tre metabolitë. Zbritja mesatare nga trupi pas administrimit nënlëkuror të liraglutidit në një dozë të vetme është afërsisht 1.2 l / orë me një gjysmë të jetës eliminatore prej afro 13 orësh.
Grupe të veçanta pacientësh
Pleqëri: Studimet farmakokinetike në një grup vullnetarësh të shëndetshëm dhe analiza e të dhënave farmakokinetike të marra në një popullatë të pacientëve (nga 18 deri në 80 vjeç) tregojnë se mosha nuk ka një efekt klinik të rëndësishëm në vetitë farmakokinetike të liraglutide.
Paul: Një analizë farmakokinetike e bazuar në popullatë e të dhënave të marra nga studimi i efekteve të liraglutidës tek pacientët femra dhe meshkuj, dhe studimet farmakokinetike në një grup të vullnetarëve të shëndetshëm tregojnë se gjinia nuk ka një efekt klinik të rëndësishëm në vetitë farmakokinetike të liraglutide.
Përkatësia etnike: Një analizë farmakokinetike e bazuar në popullatë të të dhënave të marra nga studimi i efekteve të liraglutidit në subjektet e grupeve racore të bardha, të zeza, aziatike dhe hispanike sugjeron që përkatësia etnike nuk ka një efekt klinik të rëndësishëm në vetitë farmakokinetike të liraglutide.
trashje: Një analizë farmakokinetike e bazuar në popullatë e të dhënave tregon se indeksi i masës trupore (BMI) nuk ka një efekt klinik të rëndësishëm në vetitë farmakokinetike të liraglutide.
Dështimi i mëlçisë:
Karakteristikat farmakokinetike të liraglutidit u studiuan në një studim klinik të një doze të vetme të barit në subjektet me shkallë të ndryshme të dështimit të mëlçisë. Pacientët me insuficiencë të butë hepatike (sipas klasifikimit të Child Pugh, ashpërsia e sëmundjes prej 5 - 6 pikë) dhe insuficienca e rëndë hepatike (sipas klasifikimit të Child Pugh, ashpërsia e sëmundjes> 9 pikë) u përfshinë në studim. Ekspozimi i liraglutidit në grupin e pacientëve me funksion të dëmtuar të mëlçisë nuk ishte më i lartë se ai në grupin e subjekteve të shëndetshëm, gjë që tregon se dështimi i mëlçisë nuk ka një efekt klinik të rëndësishëm në farmakokinetikën e liraglutide.
Dështimi i veshkave:
Farmakokinetika e liraglutidit është studiuar në pacientë me shkallë të ndryshme të insuficiencës renale në një studim me dozë të vetme. Ky studim përfshinte lëndë me shkallë të ndryshme të insuficiencës renale: nga i butë (vlerësimi i pastrimit të kreatininës prej 50-80 ml / min) deri tek i rëndë (vlerësimi i pastrimit të kreatininës tek fëmijët nuk u krye.
Të dhëna studimore paraprake të sigurisë
Rezultatet e studimeve preklinike toksikologjike me futjen e dozave të përsëritura të barit, përfshirë gjenotoksicitetin, treguan se përdorimi i liraglutidit nuk përbën një kërcënim për shëndetin e njeriut.
Tumoret C-qelizore tiroide te minjtë dhe minjtë u identifikuan gjatë studimeve dy vjeçare të kancerogjenitetit të ilaçit te brejtësit dhe nuk çuan në vdekje. Një dozë jo toksike (NOAEL) nuk është vendosur në minjtë. Shfaqja e tumoreve të tilla tek majmunët e trajtuar me liraglutide për 20 muaj nuk u vërejt. Rezultatet e marra në studimet mbi brejtësit shoqërohen me faktin se brejtësit janë veçanërisht të ndjeshëm ndaj mekanizmit specifik jo-gjenotoksik të ndërmjetësuar nga receptori GLP-1. Rëndësia e të dhënave të marra për njerëzit është e ulët, por nuk mund të përjashtohet plotësisht. Shfaqja e ndonjë neoplazme tjetër të lidhur me terapinë nuk u vërejt.
Studimet e kafshëve nuk kanë zbuluar një efekt të drejtpërdrejtë negativ të ilaçit mbi pjellorinë, por ka pasur një rritje të lehtë të shpeshtësisë së vdekjes së hershme embrionale gjatë trajtimit me dozën më të lartë të ilaçit. Futja e ilaçit Viktoza ® tek minjtë në mes të shtatëzanisë bëri që ata të ulnin peshën e trupit të nënës së tyre dhe rritjen e embrionit me një efekt të studiuar jo plotësisht në brinjë, dhe devijime në strukturën skeletore në grupin e lepujve. Rritja e të porsalindurve në grupin e minjve u ul gjatë terapisë me Victoza ®, dhe kjo rënie vazhdoi vazhdimisht pas ushqyerjes me gji në grupin e modeleve që morën doza të larta të liraglutidës. Nuk dihet se çfarë shkaktoi një ulje të tillë të rritjes së minjve të porsalindur - një rënie në konsumin e qumështit të nënës së tyre për shkak të ndikimit të drejtpërdrejtë të GLP-1, ose prodhimi i pamjaftueshëm i qumështit të gjirit nga minjtë e nënës për shkak të një rënie në marrjen e tyre të kalorive.
Forma e dozimit
Tretësirë nënlëkurore 6 mg / ml
1 ml zgjidhje përmban
substancë aktive - liraglutide 6 mg,
eksipientët: fosfat hidrogjen natriumi dihidrat, propilen glikol, fenol, acidi klorhidrik (zgjidhje 2M) / hidroksid natriumi (zgjidhje 2M), ujë për injeksion.
Zgjidhje transparente pa ngjyrë ose pothuajse e pangjyrë, praktikisht pa papastërti mekanike.
Dozimi dhe administrimi
Ilaçi Viktoza® përdoret një herë në ditë në çdo kohë, pavarësisht nga marrja e ushqimit, ai mund të administrohet si një injeksion nënlëkuror në bark, kofshë ose shpatull. Vendi dhe koha e injektimit mund të ndryshojnë pa rregullimin e dozës. Sidoqoftë, preferohet marrja e barit në përafërsisht në të njëjtën kohë të ditës, në kohën më të përshtatshme për pacientin. Informacione të mëtejshme mbi mënyrën e përdorimit të drogës Viktoza® mund të gjenden në seksionin për përdorim dhe asgjësim. Ilaçi Viktoza® nuk mund të përdoret për administrim intravenoz dhe intramuskular.
Doza fillestare e Victoza® është 0.6 mg në ditë. Pas përdorimit të ilaçit për të paktën një javë, doza duhet të rritet në 1.2 mg. Ekzistojnë prova që në disa pacientë, përfitimi i trajtimit rritet me një rritje të dozës së barit nga 1.2 mg në 1.8 mg. Për të arritur kontrollin më të mirë të glicemisë në një pacient dhe duke marrë parasysh efikasitetin klinik, doza e Viktoza® mund të rritet në 1.8 mg pasi ta përdorni në një dozë prej 1.2 mg për të paktën një javë. Përdorimi i barit në një dozë ditore mbi 1.8 mg nuk rekomandohet.
Ilaçi Victoza® mund të përdoret si shtesë në terapinë ekzistuese me metforminë ose terapi kombinuese me metformin dhe tiazolidinedione. Terapia me metforminë në kombinim me tiazolidinedione mund të vazhdohet në doza aktuale.
Victoza® mund të përdoret si një ndihmës gjatë terapisë ekzistuese sulfonilurea ose në terapi të kombinuar me metformin dhe sulfonylurea ose insulinë bazale. Kur Viktoza® shtohet në sulfonylurea ose terapi bazike të insulinës, duhet të konsiderohet ulja e dozës së sulfonylurea ose insulinës bazale, në mënyrë që të minimizohet rreziku i hipoglikemisë së padëshiruar (shiko seksionin "Udhëzime Speciale").
Për të rregulluar dozën e barit Viktoza®, nuk kërkohet vetë-monitorim i glukozës në gjak. Sidoqoftë, në fillim të terapisë me Viktoza® në kombinim me derivatet e sulfonylurea ose me insulinë bazale, vetë-monitorimi i tillë i glukozës në gjak mund të jetë i nevojshëm për të rregulluar dozën e përgatitjeve sulfonylurea.
Grupe të veçanta pacientësh
Të moshuar (> 65 vjeç): Nuk kërkohet zgjedhje e dozës në varësi të moshës. Ekziston një përvojë e kufizuar me përdorimin e ilaçit në pacientët e moshës 75 vjeç dhe më të vjetër (shiko seksionin "Farmakokinetika").
Pacientët me funksion të dëmtuar të veshkave
Nuk ka nevojë të rregulloni dozën në trajtimin e pacientëve me një formë të butë të dështimit renal (pastrimi i kreatininës 60 - 90 ml / min). Ekziston vetëm një përvojë shumë e kufizuar në trajtimin e pacientëve me dështim të moderuar të veshkave (pastrimi i kreatininës 30-59 ml / min) dhe nuk ka të dhëna për trajtimin e pacientëve me insuficencë të rëndë renale (pastrimi i kreatininës nën 30 ml / min). Aktualisht, Victoza nuk rekomandohet për përdorim nga pacientët me forma të rënda ose të moderuara të dështimit renal, përfshirë pacientët në fazën përfundimtare të sëmundjes renale (shiko seksionin Pharmacokinetics)
Pacientët me funksion të dëmtuar të mëlçisë
Përvoja e trajtimit të pacientëve me të gjitha format e dështimit të mëlçisë (e butë, e moderuar dhe e rëndë) aktualisht është shumë e kufizuar për të rekomanduar përdorimin e Victoza (shiko seksionin Pharmacokinetics).
Popullsia e pacientëve pediatër
Drogës Victoza nuk rekomandohet për fëmijë dhe adoleshentë nën moshën 18 vjeç për shkak të mungesës së të dhënave për sigurinë dhe efektivitetin e përdorimit të saj.
Efektet anësore
Në studimet klinike, efektet anësore të raportuara më shpesh nga trakti gastrointestinal: nauze dhe diarre (regjistruar në> 10% të pacientëve), të vjella, kapsllëk, dhimbje barku dhe simptoma dispeptike (regjistruar në recorded 1%, por 10 ≤ % e pacientëve).
Në fillim të terapisë me Viktoza®, këto efekte anësore gastrointestinale mund të ndodhin më shpesh, por me vazhdimin e trajtimit, reagimet zakonisht zvogëlohen gjatë disa ditëve ose javëve. Reagimet anësore në formën e dhimbjes së kokës dhe infeksioneve të traktit të sipërm respirator janë vërejtur relativisht shpesh (1 - 10% e pacientëve). Për më tepër, zhvillimi i kushteve hipoglikemike është i mundur, veçanërisht kur përdorni ilaçin Victoza® në kombinim me derivatet sulfonylurea (të regjistruar në> 10% të pacientëve). Hipoglikemia e rëndë zhvillohet kryesisht në sfondin e përdorimit të kombinuar të barit Viktoza® me sulfonylureas.
Efektet anësore serioze janë raportuar shumë rrallë.
Përshkrimi i reaksioneve anësore individuale
Në një studim klinik duke përdorur liraglutidin si monoterapi, incidenca e hipoglikemisë me liraglutide ishte më e ulët se incidenca e hipoglikemisë në pacientët e trajtuar me ilaçin referencë (glimepiride). Reagimet më të shpeshta anësore përfshijnë sëmundjet gastrointestinale, infeksionet dhe infeksionet.
Shumica e episodeve të hipoglikemisë së konfirmuar në provat klinike ishin të papërfillshme. Në një studim duke përdorur liraglutide si monoterapi, nuk kishte raste serioze të hipoglikemisë. Episodet serioze të hipoglikemisë nuk janë të zakonshme dhe fillimisht janë vërejtur me përdorimin e liraglutidit në kombinim me sulfonylurea (0,02 episode për vite të pacientit). Një numër shumë i vogël i episodeve (0.001 episode për vite pacient) është vërejtur me administrimin e liraglutide në kombinim me agjentë antidiabetikë oralë përveç sulfonylurea. Rreziku i hipoglikemisë është i ulët me përdorimin e kombinuar të insulinës bazale dhe liraglutidës (1.0 episod për vite pacienti, shiko seksionin Pharmacodynamics).
Reagimet anësore të gastrointestinal
Kur liraglutide dhe metformin u kombinuan, 20.7% e pacientëve raportuan të paktën një episod të nauze dhe 12.6% të pacientëve raportuan të paktën një episod diarre.
Kur liraglutide e kombinuar me sulfonylurea, 9.1% e pacientëve raportuan të paktën një episod nauze dhe 7.9% të pacientëve raportuan të paktën një episod diarre. Shumica e efekteve anësore ishin me natyrë të butë ose të moderuar dhe kishin një natyrë të varur nga doza.
Me trajtim të zgjatur, frekuenca dhe ashpërsia u ulën në shumicën e pacientëve që kishin vjellje në fazën fillestare.
Në pacientët më të vjetër se 70 vjeç, kur trajtohen me liraglutide, çrregullimet gastrointestinale mund të ndodhin më shpesh.
Në pacientët me insuficiencë renale të butë deri të moderuar (pastrimi i kreatininës prej 60-90 ml / min dhe 30-59 ml / min, përkatësisht), më shumë reagime anësore gastrointestinale mund të ndodhin gjatë trajtimit me liraglutide.
Përjashtimi i pacientëve nga gjykimet
Në gjykimet e kontrolluara për një kohë të gjatë (26 javë ose më shumë), përqindja e pacientëve të përjashtuar nga testi për shkak të reaksioneve anësore ishte 7.8% për pacientët që kaluan trajtim me liraglutide dhe 3.4% për pacientët nga grupi i trajtimit krahasues. Reagimet më të zakonshme negative që çuan në tërheqjen e gjykimit në trajtimin e pacientëve me liraglutide përfshijnë nauze (2.8% të pacientëve) dhe të vjella (1.5% të pacientëve).
Reagimet në vendin e injektimit
Një reagim në vendin e injektimit të ilaçit u raportua në afërsisht 2% të pacientëve gjatë provave klinike të kontrolluara për një kohë të gjatë të Victoza (26 javë ose më shumë). Këto reagime ishin zakonisht të vogla.
Gjatë rrjedhës së provave të gjata klinike të kontrolluara të Victoza (26 javë ose më shumë), ka pasur raportime për disa raste të pankreatitit akut (
Contraindications
- Hipersensitiviteti ndaj substancës aktive ose ndonjë tjetër
përbërësit që përbëjnë ilaçin
- përdorimi te pacientët me diabet tip 1
- për trajtimin e ketoacidozës diabetike
dështimi i rëndë renal dhe hepatik
- mosha e fëmijëve dhe adoleshentëve deri në 18 vjeç
- shtatzënia dhe laktacioni
Ndërveprimet e drogës
Vlerësimi i ndërveprimit të ilaçeve in vitro
Liraglutide tregoi një aftësi të ulët për bashkëveprimin farmakokinetik të ilaçeve për shkak të metabolizmit në sistemin citokrom P-450 (CYP), si dhe detyrues për proteinat plazmatike.
Vlerësimi i ndërveprimit të ilaçeve in vivo
Një vonesë e vogël në zbrazjen e stomakut kur përdorni liraglutide mund të ndikojë në thithjen e ilaçeve shoqëruese të destinuara për administrim oral. Studimet e ndërveprimit të drogës nuk kanë treguar ndonjë ngadalësim të rëndësishëm klinik në thithjen e këtyre barnave. Disa pacientë të trajtuar me Victoza® kishin të paktën një episod diarre akute. Diarreja mund të ndikojë në përthithjen e medikamenteve me gojë që përdoren njëkohësisht me Victoza®.
Warfarin dhe derivatet e tjera të coumarin
Studime mbi bashkëveprimin e dy ilaçeve nuk janë kryer. Në fillim të trajtimit me Victoza® në pacientët që marrin warfarin ose derivatet e tjera kumarin, rekomandohet të monitoroni INR (Marrëdhënie Ndërkombëtare të Normalizuar) më shpesh.
Liraglutide nuk shkaktoi një ndryshim në veprimin e përgjithshëm të paracetamolit pas administrimit të tij në një dozë të vetme prej 1000 mg. Përqendrimi maksimal i paracetamolit në plazmën (Cmax) u ul me 31%, dhe koha mesatare për të arritur një kulmin në përqendrimin e saj (tmax) në plazmën e gjakut u zgjat me 15 minuta. Me administrimin e njëkohshëm të liraglutidit dhe paracetamolit, nuk kërkohet rregullimi i dozës së këtij të fundit.
Liraglutide nuk shkaktoi një ndryshim klinik të rëndësishëm në efektin e përgjithshëm të atorvastatin pas administrimit të tij në një dozë të vetme prej 40 mg. Kështu, rregullimi i dozës së atorvastatin gjatë marrjes së Victoza® nuk kërkohet. Përqendrimi maksimal plazmatik i atorvastatin (Cmax) u ul me 38%, dhe koha mesatare për të arritur një kulm në përqendrimin e plazmës (tmax) në pacientët që marrin liraglutide zgjatet nga një deri në tre orë.
Liraglutide nuk shkaktoi një ndryshim në efektin e përgjithshëm të griseofulvin pas administrimit të tij në një dozë të vetme prej 500 mg. Përqendrimi maksimal i griseofulvin (Cmax) u rrit me 37%, ndërsa koha mesatare për të arritur përqendrimin e tij kulmin (tmax) në plazmë nuk ndryshoi. Rregullimi i dozës së griseofulvinit dhe ilaçeve të tjerë që kanë tretshmëri të ulët dhe përshkueshmëri të lartë nuk kërkohet.
Futja e digoksinës në një dozë të vetme prej 1 mg me përdorimin e liraglutidit tregoi një ulje të zonës nën kurbën (AUC) të digoksinës me 16%, përqendrimi maksimal plazmatik (Cmax) i digoksinës u ul me 31%. Koha mesatare për të arritur përqendrimin kulmin (tmax) të digoksinës gjatë marrjes së liraglutidit u rrit nga një në një orë e gjysmë. Bazuar në rezultatet e marra, rregullimi i dozës së digoksinës gjatë marrjes së liraglutidit nuk kërkohet.
Administrimi i lisinopril në një dozë të vetme prej 20 mg gjatë përdorimit të liraglutidit tregoi një ulje të zonës nën kurbën (AUC) të lisinopril me 15%, përqendrimi maksimal i plazmës (Cmax) i lisinopril u ul me 27%. Koha mesatare për të arritur përqendrimin e pikut (tmax) të lisinopril në plazma gjatë marrjes së liraglutidit u rrit nga gjashtë në tetë orë. Bazuar në rezultatet, nuk kërkohet rregullimi i dozës së lisinoprilit dhe digoksinës gjatë marrjes së liraglutidit.
Përqendrimi maksimal i plazmës (Cmax) i etinil estradiolit dhe levonorgestelit në doza të vetme gjatë terapisë me liraglutide u ul me përkatësisht 12% dhe 13%. Në të njëjtat kushte, koha mesatare për të arritur përqendrimin e pikut (tmax) të këtyre ilaçeve ishte 1.5 orë më vonë se zakonisht. Efekt klinikisht i rëndësishëm në efektin e përgjithshëm të etinil estradiolit dhe levonorgestelit në trup nuk ka liraglutide. Kështu, efekti i pritshëm kontraceptiv i të dy ilaçeve gjatë terapisë me liraglutide nuk ndryshon.
Asnjë bashkëveprim farmakokinetik ose farmakodinamik i liraglutidit me insulinë detemir nuk u zbulua me një përdorim të vetëm të insulinës detemir në një dozë prej 0.5 U / kg me liraglutide në një dozë prej 1.8 mg në pacientët me diabet tip mellitus.
Substancat që i shtohen Victoza® mund të shkaktojnë degradim të liraglutidit. Meqenëse nuk janë bërë teste të pajtueshmërisë, Viktoza® nuk mund të përzihet me ilaçe të tjera, përfshirë zgjidhjet e infuzionit.
Udhëzime speciale
Victoza® nuk duhet të përdoret tek pacientët me diabet mellitus tip 1 ose për trajtimin e ketoacidozës diabetike.
Victoza® nuk zëvendëson insulinën.
Përvoja me përdorimin e Victoza® në pacientët me dështim të zemrës së klasave funksionale I-II në përputhje me Klasifikimin Funksional të Dështimit Kronik të Zemrës (CHF) të Shoqatës së Kardiologjisë në New York (NYHA) është e kufizuar dhe prandaj liraglutide duhet të përdoret me kujdes. Nuk ka përvojë në trajtimin e pacientëve me insuficiencë kongresive të zemrës së klasës III - IV sipas klasifikimit të NYHA dhe për këtë arsye emërimi i liraglutidit në pacientë të tillë nuk rekomandohet.
Të dhënat për përdorimin e ilaçit Viktoza® në pacientët me sëmundje inflamatore të zorrëve dhe paresë diabetike të stomakut janë të kufizuara, përdorimi i barit Viktoza® në këto grupe pacientësh nuk rekomandohet. Përdorimi i drogës Viktoza® shoqërohet me zhvillimin e reaksioneve anësore afatshkurtra nga trakti gastrointestinal, të tilla si nauze, të vjella dhe diarre.
Përdorimi i agonistëve të tjerë GLP-1 është shoqëruar me një rrezik të zhvillimit të pankreatitit. Janë raportuar disa raste të pankreatitit akut. Pacientët duhet të informohen për simptomat karakteristike të zhvillimit të pankreatitit akut: dhimbje të forta të vazhdueshme në bark. Nëse dyshohet pankreatiti, terapia me Victoza® dhe ilaçe të tjera potencialisht të rrezikshme duhet të ndërpritet menjëherë.
Kur konfirmoni diagnozën e pankreatititit akut, përdorimi i barit Viktoza® nuk duhet të rifillohet. Kujdes duhet të tregohet kur të përshkruhet ilaçi tek pacientët me një histori të pankreatitit.
Sëmundja tiroide
Gjatë provave klinike të ilaçit Victoza®, u raportuan efekte anësore të tiroides, duke përfshirë kalcitonininë në serum të ngritur, goiter difiroksik difuz dhe neoplazma tiroide, prandaj liraglutidi duhet të përdoret me kujdes, veçanërisht në pacientët me sëmundje para-ekzistuese gjëndër tiroide (shiko pjesën "Efektet anësore").
Pacientët që marrin liraglutide në kombinim me sulfonylurea ose insulinë bazale mund të kenë një rrezik të shtuar të hipoglikemisë (shiko seksionin "Efektet anësore"). Rreziku i hipoglikemisë mund të zvogëlohet duke ulur dozën e sulfonylurea ose insulinës bazale.
Shenjat dhe simptomat e dehidrimit, përfshirë funksionin e dëmtuar të veshkave dhe dështimin akut të veshkave, janë përshkruar në pacientët që marrin liraglutide. Pacientët që marrin liraglutid duhet të këshillohen për rrezikun e mundshëm të dehidrimit në varësi të efekteve anësore nga trakti gastrointestinal dhe rekomandohet që të merren masa paraprake për të parandaluar prishjen e lëngjeve në trup.
Të dhëna studimore paraprake të sigurisë
Rezultatet e studimeve paraklinike, bazuar në studimet e pranuara përgjithësisht për sigurinë farmakologjike, toksicitetin me doza të përsëritura të barit dhe gjenotoksicitetin, treguan se përdorimi i liraglutidit nuk përbën kërcënim për shëndetin e njeriut.
Neoplazmat e qelizave C të gjëndrës tiroide të miut dhe minjve u zbuluan gjatë provave dy vjeçare të onkogjenitetit të drogës tek brejtësit dhe nuk çuan në vdekje. Asnjë dëshmi e efekteve anësore të dëmshme (NOAEL) nuk u vërejt tek minjtë. Shfaqja e këtyre neoplazmave tek majmunët e trajtuar me liraglutide për 20 muaj nuk u vërejt. Rezultatet e marra në testet mbi brejtësit shoqërohen me faktin se brejtësit janë veçanërisht të ndjeshëm ndaj peptidit -1 të glukagonit të ndërmjetësuar nga receptori i një mekanizmi specifik jo-gjenotoksik. Rëndësia e të dhënave të marra për njerëzit është e ulët, por nuk mund të përjashtohet plotësisht. Shfaqja e ndonjë neoplazme tjetër të lidhur me terapinë nuk u vërejt.
Në studimet e kafshëve, nuk kishte ndonjë efekt të drejtpërdrejtë negativ të ilaçit mbi pjellorinë, por pati një rritje të lehtë të shpeshtësisë së vdekjes së hershme embrionale gjatë trajtimit me dozën më të lartë të ilaçit. Futja e ilaçit Viktoza te minjtë në mes të periudhës së gestacionit bëri që ata të ulnin peshën e trupit të nënës dhe rritjen e embrionit me efektin mbi brinjët që nuk kuptohen plotësisht, dhe devijimet në strukturën skeletore në grupin e lepujve. Rritja e të sapolindurve në grupin e minjve gjatë terapisë me Victoza u ul, dhe kjo rënie vazhdimisht mbeti në periudhën pas gjidhënies në grupin e modeleve që morën doza të larta të liraglutidës. Nuk dihet se çfarë shkaktoi një ulje të tillë të rritjes së minjve të porsalindur - një ulje në konsumin e tyre të qumështit të nënës për shkak të ndikimit të drejtpërdrejtë të peptidit GLP-1 të glukagonit, ose prodhimi i pamjaftueshëm i qumështit të gjirit nga minjtë e nënës për shkak të një rënie në konsum të tyre të kalorive.
Pas injektimit intraarterial të liraglutidës në lepuj, u vërejt gjakderdhje e butë deri e moderuar, skuqje dhe ënjtje në vendin e injektimit.
Përdorni gjatë shtatëzënësisë dhe gjatë gjidhënies
Studimet e kafshëve nuk kanë zbuluar një efekt të drejtpërdrejtë negativ të ilaçit mbi pjellorinë, por ka pasur një rritje të lehtë të shpeshtësisë së vdekjes së hershme embrionale gjatë trajtimit me dozën më të lartë të ilaçit. Administrimi i Viktoza® te minjtë në mes të shtatëzënisë së tyre shkaktoi një ulje të peshës trupore të nënës së tyre dhe rritjen e embrionit me një efekt të studiuar jo plotësisht në brinjë, dhe devijime në strukturën e skeletit në grupin e lepujve. Rritja e individëve të porsalindur në grupin e minjve gjatë terapisë me Victoza® u ul, dhe kjo rënie vazhdoi vazhdimisht pas ushqyerjes me gji në grupin e individëve që morën doza të larta të liraglutide. Nuk dihet se çfarë shkaktoi një ulje të tillë të rritjes së minjve të porsalindur - një rënie në marrjen e qumështit të nënës së tyre për shkak të ndikimit të drejtpërdrejtë të GLP-1, ose prodhimi i pamjaftueshëm i qumështit të gjirit nga minjtë e nënës për shkak të një rënie në marrjen e tyre të kalorive.
Të dhëna adekuate për përdorimin e drogës Victoza® në gratë shtatzëna nuk janë të disponueshme. Rreziku i mundshëm për njerëzit është i panjohur.
Ilaçi Viktoza® nuk mund të përdoret gjatë shtatëzanisë, përkundrazi, rekomandohet të kryhet trajtim me insulinë. Nëse pacienti po përgatitet për shtatëzani, ose shtatzënia tashmë ka filluar, terapia me Victoza® duhet të ndërpritet menjëherë.
Nuk ka përvojë me përdorimin e drogës Victoza® në gratë infermiere, përdorimi i barit gjatë ushqyerjes me gji është i kundërindikuar.
Karakteristikat e efektit të drogës në aftësinë për të drejtuar automjete dhe mekanizmat potencialisht të rrezikshëm
Një studim mbi efektin e drogës Victoza® mbi aftësinë për të drejtuar automjete dhe për të punuar me mekanizma nuk është bërë. Pacientët duhet të paralajmërohen se duhet të marrin masa paraprake në mënyrë që të shmangin zhvillimin e një gjendje hipoglikemie gjatë vozitjes dhe kur punoni me mekanizma, veçanërisht nëse Victoza® merret si pjesë e terapisë së kombinuar me sulfonylureas ose me insulinë bazale.
Mbidozë
Simptomat: gjatë një studimi klinik të Victoza®, një nga pacientët me diabet tip 2 pësoi një mbidozë të barit në formën e një injeksioni nënlëkuror në një dozë prej 72 mg (40 herë doza maksimale e rekomanduar prej 1.8 mg). Mbidozimi shkaktoi nauze dhe të vjella të rënda. Asnjë hipoglikeminë nuk u vërejt. Pacienti u shërua plotësisht pa komplikime.
Trajtimi: rekomandohet terapi e përshtatshme simptomatike, në varësi të shenjave dhe simptomave klinike.
Pharmacodynamics
Liraglutide është një analog i GLP-1 i njeriut (peptid-1 i ngjashëm me glukagon). Prodhuar me metodën e bioteknologjisë së ADN-së rekombinuese (acid deoksiribonukleik) duke përdorur llojin Saccharomyces cerevisiae, i cili ka 97% homologji me GLP-1 të njeriut, lidh dhe aktivizon receptorët GLP-1 te njerëzit.
Receptori GLP-1 është një objektiv për GLP-1 amtare, i cili është një hormon endogjen i incretinës, i cili stimulon sekretimin e insulinës në varësi të glukozës në qelizat β pankreatike. Në krahasim me GLP-1 amtare, profilet farmakodinamike dhe farmakokinetike të liraglutidit lejojnë që ajo të administrohet një herë në ditë.
Me injeksion nënlëkuror, profili me veprim të gjatë i substancës bazohet në tre mekanizma:
- vetë-shoqatë, e cila siguron thithjen e vonuar të liraglutidit,
- detyrues për albumin,
- niveli më i lartë i qëndrueshmërisë enzimatike ndaj DPP-4 (dipeptidil peptidaz-4) dhe NEP (endopeptidaza neutrale enzimë), e cila siguron T gjatë1/2 (gjysmë jeta) e një substance nga plazma.
Efekti i liraglutidit bazohet në bashkëveprimin me receptorët specifikë GLP-1, si rezultat i të cilave rritet niveli i cAMP (monofosfati ciklik i adenozinës). Nën veprimin e substancës, vërehet stimulim i varur nga insulina që varet nga glukoza, dhe funksioni i qelizave β pankreatike përmirësohet. Në të njëjtën kohë, ndodh shtypja e varur nga glukagoni në varësi të glukozës. Kështu, me një rritje të përqendrimit të glukozës në gjak, sekretimi i glukagonit shtypet dhe stimulohet sekretimi i insulinës.
Nga ana tjetër, në pacientët me hipoglikeminë, liraglutid ul sekretimin e insulinës pa frenuar sekretimin e glukagonit. Mekanizmi për uljen e glicemisë gjithashtu përfshin një vonesë të vogël në zbrazjen e stomakut. Duke përdorur mekanizma që shkaktojnë një ulje të urisë dhe një ulje të shpenzimit të energjisë, liraglutide çon në një ulje të indit dhjamor dhe humbje peshe.
GLP-1 është një rregullator fiziologjik i marrjes së oreksit dhe kalorive, receptorët e këtij peptidi ndodhen në disa zona të trurit që janë të përfshirë në rregullimin e oreksit.
Gjatë kryerjes së studimeve për kafshët, u zbulua se përmes aktivizimit specifik të receptorëve GLP-1, liraglutid rrit sinjalet e ngopjes dhe dobëson sinjalet e urisë, duke çuar kështu në humbje peshe.
Gjithashtu, sipas studimeve të kafshëve, liraglutide ngadalëson zhvillimin e diabetit. Substanca është një faktor i fuqishëm në stimulimin specifik të përhapjes së qelizave β qelizore pankreatike dhe parandalon vdekjen e qelizave β (apoptozë), e cila është shkaktuar nga citokinat dhe acidet yndyrore të lira. Kështu, liraglutidi rrit biosintezën e insulinës dhe rrit masën e qelizave β. Pas normalizimit të përqendrimit të glukozës, liraglutid ndalon rritjen e masës së qelizave β pankreatike.
Viktura ka një efekt të gjatë 24-orësh dhe përmirëson kontrollin e glicemisë, e cila arrihet duke ulur përqendrimin e glukozës në gjak të agjëruar dhe pas ngrënies me diabet tip 2.
Grupi farmakologjik
Medikamente të tjera hipoglikemike, me përjashtim të insulinës.
Kodi ATC A10V X07.
Victoza® përdoret për të trajtuar diabetin mellitus tip II tek të rriturit me qëllim që të arrihet kontrolli i glicemisë në kombinim me:
- metformina ose sulfonylurea në pacientët me kontroll të dobët të glicemisë, pavarësisht përdorimit të dozave maksimale të toleruara të metforminës ose sulfonylurea si monoterapi,
- metformin dhe sulfonylureas, ose metformin dhe tiazolidinediones në pacientët me kontroll të dobët të glicemisë, pavarësisht terapisë të dyfishtë.
Terapia e kombinimit me insulinën bazale te pacientët që nuk kanë arritur kontroll të duhur glicemik me ndihmën e Viktoza dhe metformin.
Reaksione anësore
Në pesë studime të mëdha, afatgjata klinike, më shumë se 2500 pacientë morën vetëm Victoza® ose kombinimin e saj me metformin, me glimepiride (me ose pa metformin), sulfonylurea (me ose pa metformin), ose me metformin + rosiglitazone.
Vlerësimi i incidencës së efekteve anësore u krye në shkallën vijuese: shumë shpesh
(≥ 1/10), shpesh (nga 1/100 në to - 2501). Prezantohen reagimet e mëposhtme anësore, incidenca e të cilave në grupin e pacientëve që pranojnë ilaçin Viktoza® tejkaluan më shumë se 5% frekuencën në grupin ku ata morën ilaçin krahasues. Përfshihen edhe reaksione anësore, incidenca e të cilave është ³1%, por ato ndodhin më shumë se 2 herë më shpesh në krahasim me ilaçin krahasues.
Disordersrregullime metabolike dhe ushqyese: shpesh - hipoglikemia, anoreksia, ul oreksi rrallë - dehidrim *.
Disrregullime të sistemit nervor: shpesh - dhimbje koke, marramendje.
Disrregullimet e tretjes: shumë shpesh - nauze, diarre, shpesh - të vjella, dispepsi, dhimbje në pjesën e sipërme të barkut, kapsllëk, gastrit, fryrje, bloating, sëmundje refluksi gastroesophageal, belching, dhimbje dhëmbi, gastroenterit viral shumë rrallë - (pankreatiti (përfshirë nekrotik pankreatiti).
Disrregullime kardiovaskulare: shpesh - rritje e rrahjeve të zemrës (HR).
Disrregullimet e sistemit imunitar: rrallë reagime anafilaktike.
Infeksione dhe infeksione: shpesh - infeksione të traktit të sipërm respirator (nazofaringit, bronkit).
Disordersrregullime të përgjithshme dhe gjendja e vendit të injektimit: rrallë - keqtrajtim, shpesh - lodhje, ethe, reagime në vendin e injektimit.
.Rregullimet e veshkave dhe traktit urinar : rrallë - dështimi akut renal *, funksioni i dëmtuar i veshkave *.
Nga ana e lëkurës dhe indit nënlëkuror : shpesh - skuqje, rrallë - urtikarie, kruajtje.
(* Shihni seksionin Karakteristikat e Aplikimit).
Përshkrimi i reaksioneve anësore individuale
Gjatë një studimi klinik të monoterapisë monoterike Viktoza®, incidenca e hipoglikemisë në pacientët që marrin Victoza® ishte më e ulët sesa në pacientët që pranonin ilaçin referencë aktiv (glimepiride). Reagimet më të zakonshme negative ishin ngërçet gastrointestinale, infeksionet dhe infeksionet.
Në shumicën e rasteve të regjistruara gjatë provave klinike, hipoglikemia e konfirmuar ishte e papërfillshme. Gjatë monoterapisë me Viktoza®, nuk pati asnjë rast të vetëm të hipoglikemisë së rëndë. Hipoglikemia e rëndë ndodh rrallë dhe vërehet kryesisht me trajtim të kombinuar me Viktoza® dhe sulfonylurea (0.02 raste / vite-pacient). Shumë rrallë (0,001 raste / vite-pacient) ka pasur raste të hipoglikemisë gjatë trajtimit me Victoza® në kombinim me ilaçe të tjera antidiabetike oral (d.m.th. jo me sulfonylurea).
Pas administrimit shtesë të insulinës për të shqetësuar pacientët, ata morën liraglutid 1.8 mg metforminë; nuk pati raste të hipoglikemisë së rëndë. Incidenca e hipoglikemisë së butë ishte 0.286 raste në vit të pacientit. Në grupet e krahasimit, incidenca e hipoglikemisë së butë ishte 0,029 raste në vit-pacient në trajtimin me liraglutide
1.8 mg dhe 0.129 raste në vit-pacient me trajtim metformine.
Disordersrregullimet e tretjes
Shumica e rasteve të nauze ishin të buta ose të moderuara, të përkohshme dhe rrallë çuan në tërheqjen e terapisë.
Me trajtimin e kombinuar me Victoza® dhe metformin, nauze ka ndodhur të paktën një herë në 20.7% të pacientëve, dhe diarre në 12.6% të pacientëve. Kur u kombinua me Viktoza® dhe sulfonylurea, nauze ka ndodhur të paktën një herë në 9.1% të pacientëve, dhe diarre në 7.9%. Shumica e rasteve ishin të buta ose të moderuara në ashpërsi dhe ishin të varura nga doza.
Në pacientët mbi 70 vjeç, çrregullimet e sistemit të tretjes mund të ndodhin me trajtimin me Victoza®.
Në pacientët me funksion të butë të dëmtuar të veshkave (pastrimi i kreatininës prej 60-90 ml / min), çrregullimet e sistemit tretës mund të ndodhin më shpesh me trajtim me Viktoza®.
Tërheqja e drogës
Gjatë provave të kontrolluara për një kohë të gjatë (26 javë ose më gjatë), frekuenca e tërheqjes së ilaçit Viktoza® për shkak të reaksioneve anësore që ndodhën ishte 7.8%, dhe tërheqja e barit krahasues ishte 3.4%. Shkaku më i zakonshëm i kësaj tek pacientët që marrin Victoza® ishte nauze (2.8%) dhe të vjella (1.5%).
Për shkak të vetive të mundshme imunogjenike të barnave që përmbajnë proteina ose peptide, antitrupat anti-liraglutidn mund të formohen në pacientët e trajtuar me Victoza®. Ata u gjetën në një mesatare prej 8.6% të pacientëve. Formimi i antitrupave nuk shoqërohej me një ulje të efektivitetit të Victoza®.
Reagimet e vendit të injektimit
Gjatë provave të kontrolluara për një kohë të gjatë (26 javë ose më gjatë), reagimet në vendin e injektimit të Viktoza® u raportuan në rreth 2% të pacientëve. Këto reagime ishin zakonisht të buta.
Gjatë provave të gjata klinike, disa raste u raportuan gjatë trajtimit me Viktoza® (® nuk u përcaktua as u përjashtua.
Mosfunksionimi i tiroides
Incidenca totale e mosfunksionimit të tiroides gjatë gjithë studimeve (kohëzgjatje e mesme dhe e gjatë) ishte 33.5, 30.0 dhe 21.7 raste në 1000 vjet pacientë të ekspozimit të plotë të liraglutides, placebo dhe ilaçeve krahasuese, me 5.4 , Respektivisht, 2.1 dhe 0.8 raste, iu atribuan reagimeve të rënda anësore.
Në pacientët e trajtuar me Victoza®, tumoret e tiroides, nivelet e larta të kalcitoninës në gjak dhe goiter u vërejtën më shpesh.
Pas lansimit të Victoza® në treg, janë raportuar reaksione alergjike, përfshirë urtikarinë, skuqjen dhe pruritusin. Janë raportuar gjithashtu disa raste të reaksioneve anafilaktike me simptoma shtesë si hipotension, palpitacione, dispne dhe edemë.
Përdorni gjatë shtatëzanisë dhe laktacionit
Të dhëna adekuate për përdorimin e drogës Viktoza® nga gratë shtatzëna nuk janë të disponueshme. Studimet e kafshëve kanë treguar toksicitetin riprodhues (shiko Seksionin "Të dhënat paraprake të sigurisë"). Rreziku i mundshëm për njerëzit është i panjohur.
Ilaçi Viktoza® nuk duhet të përdoret gjatë shtatëzanisë, në vend të kësaj rekomandohet të përshkruhet insulinë. Nëse pacienti dëshiron të mbetet shtatzënë ose shtatzënë, atëherë ilaçi Victoza ® duhet të ndërpritet.
Periudha e laktacionit
Nuk dihet nëse liraglutidi ekskretohet në qumështin e gjirit. Studimet e kafshëve kanë treguar që sasi të parëndësishme të liraglutideve dhe metabolitëve strukturorë të saj të lidhur ngushtë futen në qumësht. Për shkak të përvojës së pamjaftueshme gjatë ushqyerjes me gji, ilaçi nuk duhet të përdoret Viktoza®.
Për shkak të mungesës së të dhënave, Victoza® nuk rekomandohet për fëmijë.
Karakteristikat e aplikacionit
Victoza® nuk përdoret për të trajtuar pacientët me diabet mellitus tip 1 ose ketoacidozë diabetike.
Viktoza® nuk është një zëvendësues i insulinës.
Efektiviteti i marrjes shtesë të liraglutidit në pacientët që tashmë po mjekohen me insulinë, dhe nuk vlerësohen.
Përvoja e trajtimit të pacientëve me dështim kongjestiv të zemrës së klasave I-II (sipas klasifikimit të Shoqatës së Kardiologjisë së Nju Jorkut - NYHA) është e kufizuar, dhe nuk ka të dhëna për trajtimin e pacientëve me dështim kongjestiv të zemrës së klasave III-IV.
Për shkak të përvojës së kufizuar, nuk rekomandohet të përshkruhet ilaçi Viktoza® te pacientët me sëmundje inflamatore të zorrëve dhe gastroparesis diabetike.
Përdorimi i analogëve të tjerë të GLP-1 shoqërohet me një rrezik të zhvillimit të pankreatitit. Ekzistojnë një numër raportimesh për pankreatitin akut. Pacientët duhet të informohen për simptomat karakteristike të pankreatitit akut (dhimbje të vazhdueshme, të forta në zgavrën e barkut). Nëse dyshohet pankreatiti, trajtimi me Viktoza® dhe ilaçe të tjera provokuese duhet të ndërpritet.
Gjatë provave klinike, reagimet anësore të vërejtura nga gjëndra tiroide janë një rritje e nivelit të kalcitoninës në gjak, goiter dhe tumor, veçanërisht në pacientët me sëmundje ekzistuese tiroide (shiko seksionin "Reaksione anësore").
Pacientët e trajtuar me Victoza® përjetuan simptoma të dehidrimit, përfshirë funksionin e dëmtuar të veshkave dhe dështimin akut të veshkave.
Pacientët të cilët janë të destinuar për Victoza® duhet të paralajmërohen për mundësinë e dehidrimit për shkak të çrregullimeve të sistemit tretës dhe nevojës për të marrë masa paraprake për dehidrim.
Në pacientët që marrin ilaçin Viktoza® njëkohësisht me sulfonylurea, rreziku i zhvillimit të hipoglikemisë është rritur (shih pjesën "Reagimet anësore"). Rreziku i hipoglikemisë mund të zvogëlohet duke zvogëluar dozën e sulfonylurea.
Aftësia për të ndikuar në shkallën e reagimit kur drejtoni automjete ose mekanizma të tjerë
Studime mbi efektin e drogës Victoza® në aftësinë për të drejtuar automjete dhe mekanizma të tjerë nuk janë kryer. Pacientët duhet të këshillohen që të marrin masa për të parandaluar shfaqjen e hipoglikemisë gjatë periudhës së drejtimit të automjetit ose mekanizmit tjetër, veçanërisht kur përdorni ilaçin Viktoza® njëkohësisht me sulfonylurea.
Ndërveprimi me ilaçet e tjera dhe llojet e tjera të ndërveprimeve .
In vitro liraglutide tregoi një potencial shumë të ulët për farmakokinetikën e substancave të tjera aktive, shkëmbimi i të cilave shoqërohet me citokrom 450 si dhe lidhet me proteinat plazmatike.
Liraglutide shkakton një vonesë të vogël në zbrazjen e stomakut, mund të ndikojë në thithjen e ilaçeve të përdorura njëkohësisht brenda.
Liraglutide nuk e ndryshoi ekspozimin total të paracetamolit pas një doze të vetme prej 1000 mg. Përqendrimi maksimal i paracetamolit (C max ) u ul me 31%, dhe koha për të arritur përqendrimin maksimal (t max ) u rrit në 15 minuta. Me përdorimin e njëkohshëm të paracetamolit, nuk kërkohet rregullimi i dozës.
atorvastatin Liraglutide nuk e ndryshoi ekspozimin total të atorvastatin të një niveli klinikisht të rëndësishëm pas një doze të vetme të tij në një dozë prej 40 mg. Në këtë drejtim, me përdorimin e njëkohshëm të rregullimit të dozës së Viktozoy® nuk është i nevojshëm. Bashkë administruar me liraglutide C max atorvastatin u ul me 38%, dhe t max rritur nga 1:00 në 3:00.
Griseofulvina Liraglutide nuk e ndryshoi ekspozimin total të griseofulvin pas një doze të vetme prej 500 mg. C max rritur me 37%, ndërsa t max nuk ndryshoi. Rregullimi i dozës kur përdorni griseofulvin dhe komponime të tjera të rrënjës së ulët me përshkueshmëri të lartë nuk kërkohet.
Lisinoprili dhe digoksina
Pas një injeksioni të vetëm prej 20 mg lisinopril ose 1 mg digoxin në kombinim me liraglutide, një rënie në zonën nën kurbën e përqendrimit-kohë (AUC) të këtyre ilaçeve është vërejtur me 15% dhe 16%, përkatësisht, me C max ulur përkatësisht me 27% dhe 31%. T max lisinopril u rrit nga 6:00 në 8:00, ndërsa digoksina u rrit nga 1:00 në 1.5 orë. Bazuar në këto rezultate, gjatë përdorimit të liraglutidit, rregullimi i dozës së lisinoprilit ose digoksinës nuk është i nevojshëm.
Me përdorimin e një doze të vetme të kontraceptivëve oral, liraglutid ulur C max etinil estradiol ose levonorgestrel me 12% dhe 13%, përkatësisht, dhe t max rritur me 1.5 orë. Kjo nuk tregoi një efekt klinik në ekspozimin total të etinil estradiolit ose levonorgestelit, i cili sugjeron që administrimi i njëkohshëm i liraglutidit nuk do të ndikojë në efektin kontraceptiv të etinil estradiolit dhe levonorgestrelit.
Warfarin dhe derivatet e tjera të coumarin
Asnjë studim mbi ndërveprimin e ilaçeve nuk është kryer. Në fillim të trajtimit me Viktoza® për pacientët që marrin warfarin ose derivatet e tjera kumarin, rekomandohet monitorim i shpeshtë i INR (Raporti Ndërkombëtar i Normalizuar).
Në pacientët me diabet të stabilizuar tip 2 me një administrim të njëkohshëm të insulinës, detemir (5 U / kg) dhe liraglutide (1.8 mg) nuk treguan shenja të bashkëveprimit farmakokinetik dhe farmakodinamik.
Farmakokinetika
Pas administrimit nënlëkuror, thithja e liraglutidit është e ngadaltë, Tmax (koha për të arritur përqendrim maksimal) në plazmë është 8-12 orë. Cmax (përqendrimi maksimal) në plazëm pas administrimit të një doze të vetme prej 0.6 mg është 9.4 nmol / L. Kur përdorni një dozë prej 1.8 mg mesatare Css (përqendrimi i ekuilibrit) në plazmë arrin afërsisht 34 nmol / L. Ekspozimi i substancës përmirësohet në përpjesëtim me dozën. Koeficienti intra-individual i variacionit për AUC (zona nën kurbën e përqendrimit-kohë) pas administrimit të liraglutide në një dozë të vetme është 11%. Disponueshmëria biologjike e plotë është rreth 55%.
Duke parë Vd (vëllimi i shpërndarjes) i liraglutidit në indet me rrugë administrimi nënlëkuror është 11-17 l, vlera mesatare e Vd pas administrimit intravenoz - 0,07 l / kg. Vihet re një lidhje e rëndësishme e liraglutidit me proteinat plazmatike (> 98%).
Metabolizmi i liraglutidit ndodh si proteina të mëdha, pa marrë pjesë si një rrugë për sekretimin e ndonjë organi specifik. Për 24 orë pas administrimit të një doze të vetme, substanca e pandryshuar mbetet përbërësi kryesor i plazmës. Dy metabolitë u zbuluan në plazmë (≤ 9 dhe% 5% e dozës totale).
Liraglutidi i pandryshuar pas administrimit të një doze prej 3 H-liraglutide në urinë ose feces nuk është përcaktuar. Vetëm një pjesë e vogël e metabolitëve të lidhur me substancën ekskretohen nga veshkat ose përmes zorrëve (përkatësisht 6 dhe 5%). Pas administrimit nënlëkuror të një doze të vetme liraglutide, pastrimi mesatar nga trupi është afërsisht 1.2 l / orë me eliminim T1/2 rreth 13 orë.
Forma e lëshimit dhe paketimi
3 ml të ilaçit në një fishek qelqi 1 klasa hidrolitike, e mbështjellë me një disk prej gome bromobutil / polisoprene nga njëra anë dhe një pistoni prej gome bromobutyl nga ana tjetër. Fishek është mbyllur në një stilolaps plastike të disponueshme për injeksione të shumta.
2 shiringa të disponueshme plastike për injeksione të shumta, së bashku me udhëzimet për përdorim mjekësor në shtetin dhe gjuhët ruse vendosen në një pako kartoni.
Pendo stilolaps shiringë (3 ml) përmban 30 doza prej 0.6 mg, 15 doza prej 1.2 mg ose 10 doza prej 1.8 mg liraglutide.
Indikacionet për përdorim
Sipas udhëzimeve, Viktoza përdoret për diabetin tip 2 në kombinim me dietën dhe stërvitjen për të arritur kontrollin e glicemisë.
Mënyrat e mundshme të përdorimit të ilaçit:
- monoterapi,
- terapi kombinuese me një ose më shumë agjentë hipoglikemikë oralë (tiazolidinediones, sulfonylureas, metformin) në pacientët që nuk arritën të arrijnë kontroll të duhur glicemik gjatë terapisë së mëparshme,
- terapi kombinuese me insulinë bazale te pacientët që nuk arritën të arrijnë një kontroll adekuat të glicemisë duke përdorur Victoza në kombinim me metformin.
Udhëzime për përdorim Victoza: metodë dhe dozë
Victoza duhet të administrohet në mënyrë subkutane në bark, shpatull ose kofshë një herë në ditë, pavarësisht ushqimit. Vendi dhe koha e injektimit mund të ndryshohen pa rregullimin e dozës, megjithatë, është e dëshirueshme që të administrohet ilaçi në të njëjtën kohë të ditës, gjë që është më e përshtatshme për pacientin.
Për të përmirësuar tolerancën gastrointestinale, rekomandohet trajtimi me një dozë ditore prej 0.6 mg. Pas një minimumi në javë, doza rritet në 1.2 mg. Nëse është e nevojshme, për të arritur kontrollin më të mirë të glicemisë, duke marrë parasysh efektivitetin klinik të Victoza, një rritje e dozës në 1.8 mg është e mundur të paktën një javë më vonë. Përdorimi i dozave më të larta nuk rekomandohet.
Ilaçi mund të përshkruhet përveç terapisë në vazhdim me metformin ose terapi kombinuese me metformin në kombinim me tiazolidinedione. Dozat e kësaj të fundit nuk kanë nevojë të rregullohen.
Fitores mund t’i shtohet terapia derivative ekzistuese sulfonilurea ose terapia e kombinimit të metforminës në kombinim me derivatet e sulfonylurea. Në këtë rast, për të minimizuar rrezikun e zhvillimit të hipoglikemisë së padëshiruar, doza e derivateve të sulfonylurea duhet të zvogëlohet.
Victoza gjithashtu mund të shtohet në insulinë bazale, por për të zvogëluar rrezikun e hipoglikemisë, është e nevojshme të zvogëlohet doza e insulinës.
Në rast të humbjes së dozës:
- nëse nuk kanë kaluar më shumë se 12 orë, duhet të futni dozën e humbur sa më shpejt që të jetë e mundur,
- nëse kanë kaluar më shumë se 12 orë, doza tjetër duhet të administrohet ditën tjetër në kohën e caktuar, d.m.th., nuk është e nevojshme të kompensohet doza e humbur duke futur një dozë shtesë ose të dyfishuar.
Udhëzime për përdorimin e drogës
Pendo stilolaps shiringë është projektuar për përdorim individual.
Ilaçi duhet të administrohet duke përdorur gjilpëra deri në 8 mm të gjata dhe deri në 32G të trasha (pa përfshirë, prandaj blihet veç e veç). Stilolapsat e shiringave kombinohen me hala për injeksion të disponueshëm NovoTvist dhe NovoFayn.
Victoza nuk duhet të administrohet nëse zgjidhja duket ndryshe nga një lëng i qartë, pothuajse i pangjyrë ose pa ngjyrë.
Ju nuk mund të hyni në ilaç nëse ka pësuar ngrirje.
Mos e ruajeni lapsin e shiringës me gjilpërën e bashkangjitur. Pas çdo injeksioni, ajo duhet të hidhet poshtë. Kjo masë parandalon rrjedhjen, ndotjen dhe infeksionin e barit, dhe gjithashtu garanton saktësinë e dozimit.
Kushtet e ruajtjes
Ruani në temperaturë 2 ° C deri 8 ° C (në frigorifer). Mos u ngrini.
Për stilolaps shiringë në përdorim: përdorni brenda 1 muaji. Ruani në një temperaturë që nuk kalon 30 ° C ose nga 2 º C deri 8 º C (në frigorifer). Mos u ngrini. Mos e ruani me gjilpërë të bashkangjitur. Mbuloni stilolapsin e shiringës me një kapak për ta mbrojtur atë nga drita.
Mbajeni larg mundësive të fëmijëve!
Përdorimi dhe Udhëzimi i Shkatërrimit
Victoza® nuk mund të përdoret nëse duket ndryshe nga një lëng i qartë dhe pa ngjyrë ose pothuajse i pangjyrë.
Victoza® nuk mund të përdoret nëse është ngrirë.
Victoza® mund të administrohet duke përdorur gjilpëra deri në 8 mm të gjata dhe deri në 32G të trasha. Lapsa shiringë është menduar për t'u përdorur në kombinim me gjilpërat e injektimit të disponueshëm NovoFine® ose NovoTvist®.
Gjilpërat e injektimit nuk janë përfshirë në paketë.
Pacienti duhet të informohet se gjilpëra e përdorur duhet të hidhet pas çdo injeksioni, dhe gjithashtu që shiringa e stilolapsit me gjilpërën e bashkangjitur nuk mund të ruhet. Një masë e tillë do të parandalojë ndotjen, infeksionin dhe rrjedhjen e barit nga stilolapsa shiringë dhe garanton dozimin e saktë.